Many Variant Strains Were Already Present Before the First Known Cases Identified in China
0 View
Share this Video
- Publish Date:
- 4 May, 2021
- Category:
- Covid
- Video License
- Standard License
- Imported From:
- Youtube
Tags
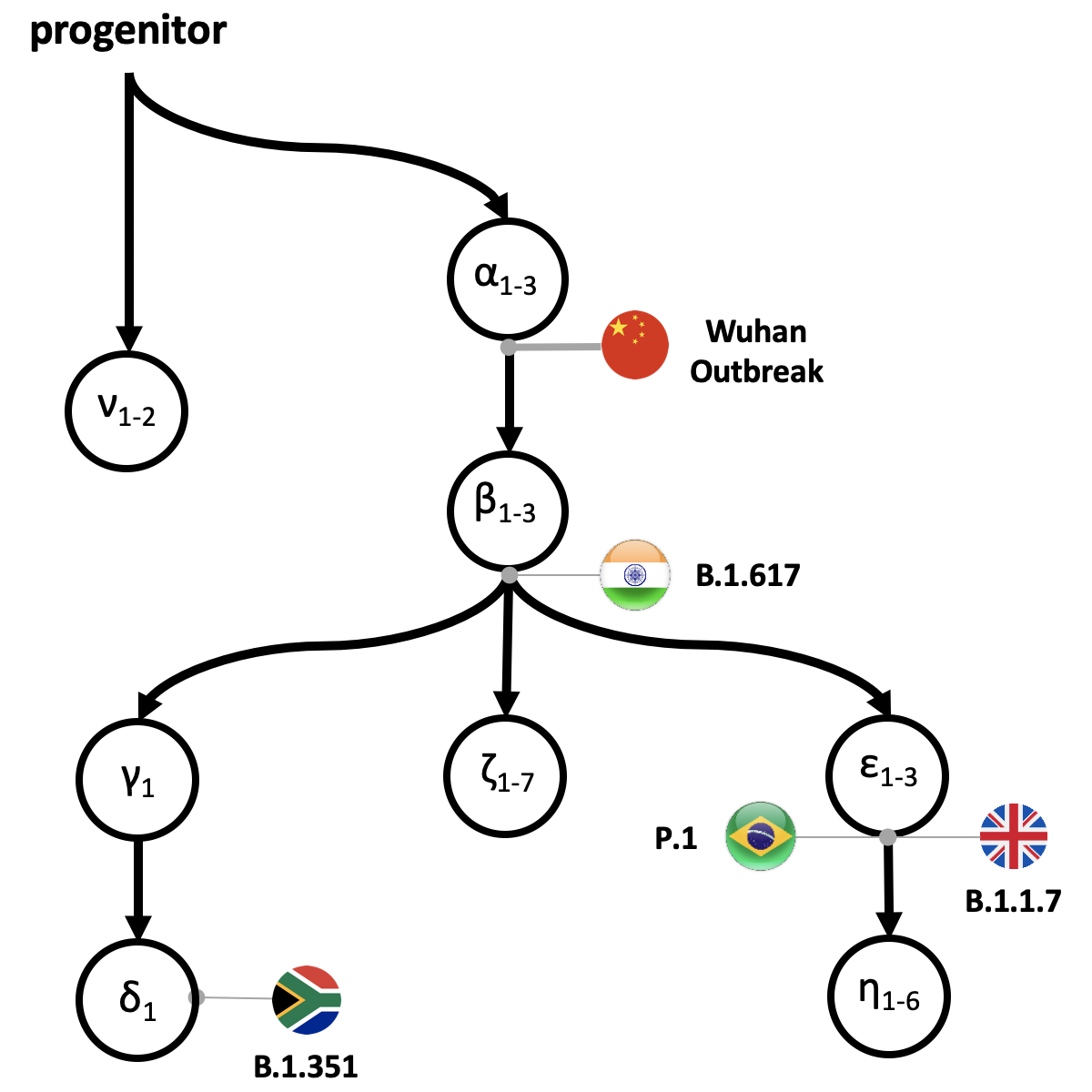
Het progenitor-virus (proCoV2) en zijn eerste nakomelingen ontstonden in China, op basis van de vroegste mutaties van proCoV2 en hun locaties, die werden teruggevoerd op 6-8 weken voorafgaand aan de uitbraak in Wuhan China. Bovendien toonde het wetenschapsteam ook aan dat er ten tijde van de eerste detectie van COVID-19-gevallen in China een populatie van stammen met ten minste drie mutatieverschillen (alfa 1-3) van proCoV2 bestond. De huidige belangrijkste varianten van interesse, waaronder het VK (B.1.1.1.7), Zuid-Afrikaans (B.1.351), Zuid-Amerikaans (P.1) en nu Indiaas (B.1.617), worden weergegeven in de stamboom. Deze varianten zijn niet alleen gekomen om eerdere dominante stammen in hun respectievelijke regio’s te vervangen, maar vormen nog steeds een bedreiging voor de wereldgezondheid vanwege hun potentieel om te ontsnappen aan de huidige vaccins en therapieën. Krediet: Sudhir Kumar, Temple University
Nieuwe studie traceert de voorlopercellen die COVID-19 en geospatiale verspreiding veroorzaken.
Op het gebied van moleculaire epidemiologie is de wereldwijde wetenschappelijke gemeenschap gestaag bezig geweest om het raadsel van de vroege geschiedenis van SARS-CoV-2 op te lossen. Ondanks recente inspanningen van de Wereldgezondheidsorganisatie heeft niemand tot nu toe het eerste geval van menselijke overdracht, of “patiënt nul”, in de COVID-19-pandemie geïdentificeerd.
Het vinden van het vroegst mogelijke geval is nodig om beter te begrijpen hoe het virus mogelijk als eerste uit zijn dierlijke gastheer is gesprongen om mensen te infecteren, evenals de geschiedenis van hoe het SARS-CoV-2 virale genoom in de loop van de tijd is gemuteerd en zich wereldwijd heeft verspreid.
Sinds de eerste SARS-CoV-2-virusinfectie werd gedetecteerd in december 2019, zijn wereldwijd meer dan een miljoen genomen van SARS-CoV-2 gesequenced, waaruit blijkt dat het coronavirus muteert, zij het langzaam, met een snelheid van 25 mutaties per genoom. per jaar. Het enorme aantal opkomende varianten, waaronder het VK (B.1.1.1.7), Zuid-Afrikaans (B.1.351), Zuid-Amerikaans (P.1) en nu Indiaas (B.1.617), vervangen niet alleen de eerdere dominante stammen in hun respectievelijke regio’s, maar vormen nog steeds een bedreiging voor de wereldgezondheid vanwege hun potentieel om te ontsnappen aan de huidige vaccins en therapieën.
“Het SARS-CoV-2-virus heeft al meer dan 145 miljoen mensen besmet en veroorzaakte 3 miljoen doden over de hele wereld”, zegt Sudhir Kumar, directeur van het Institute for Genomics and Evolutionary Medicine, Temple University. “We gingen op zoek naar de genetische gemeenschappelijke voorouder van al deze infecties, die we het voorlopercellengenoom noemen.”
Dit voorlopercellengenoom (proCoV2) is de moeder van alle SARS-CoV-2 coronavirussen die mensen hebben geïnfecteerd en nog steeds infecteren.
Bij afwezigheid van patiënt nul hebben Kumar en zijn onderzoeksteam nu misschien het op één na beste gevonden om het wereldwijde detectivewerk voor moleculaire epidemiologie te ondersteunen. “We hebben het genoom van de stamvader en zijn vroege stamboom gereconstrueerd door een grote dataset van coronavirusgenomen te gebruiken die sinds december 2019 is verkregen van geïnfecteerde individuen”, zegt Kumar, de hoofdauteur van een nieuwe studie, die verscheen in de geavanceerde online-editie van het tijdschrift Molecular Biology. en evolutie.
Ze ontdekten dat de stamvader aanleiding gaf tot een familie van coronavirusstammen, waarvan de leden de stammen omvatten die in december 2019 in Wuhan, China werden aangetroffen. “In wezen vertegenwoordigden de gebeurtenissen in december in Wuhan, China, de eerste superspreader-gebeurtenis van een virus. die over alle tools beschikten die nodig waren om een wereldwijde pandemie direct uit de doos te veroorzaken, ”zei Kumar.
Kumar’s groep schat dat de SARS-CoV-2-progenitor al circuleerde met een eerdere tijdlijn – ten minste 6 tot 8 weken voorafgaand aan het eerste genoom waarvan de sequentie in China werd bepaald, bekend als Wuhan-1. “Deze tijdlijn plaatst de aanwezigheid van proCoV2 eind oktober 2019, wat consistent is met het rapport van een fragment van spike-eiwit identiek aan Wuhan-1 begin december in Italië, naast ander bewijs”, zei Sayaka Miura, een senior auteur van de studie.
“We hebben in januari 2020 en later een genetische vingerafdruk van voorlopers gevonden bij meerdere coronavirusinfecties in China en de VS. De voorloper verspreidde zich maanden voor en na de eerste gerapporteerde gevallen van COVID-19 in China wereldwijd ”, aldus Pond.
Naast hun bevindingen over de vroege geschiedenis van SARS-CoV-2, heeft Kumar’s groep ook intuïtieve mutatie-vingerafdrukken en Griekse symboolclassificatie ontwikkeld (ν, α, β, γ, δ en ε) om de categorisering van de belangrijkste stammen, substammen te vereenvoudigen. en varianten die een individu infecteren of een globale regio koloniseren. Dit kan wetenschappers helpen om de volgorde van opkomst van nieuwe varianten beter te traceren en context te bieden.
“Over het algemeen bieden onze mutationele vingerafdrukken en nomenclatuur een eenvoudige manier om de afkomst van nieuwe varianten te achterhalen in vergelijking met fylogenetische aanduidingen, bijvoorbeeld B.1.351 en B.1.1.7,” zei Kumar.
Een α-vingerafdruk verwijst bijvoorbeeld naar genomen die een of meer van de α-varianten zijn en geen andere volgende hoofdvarianten, en αβ-vingerafdruk verwijst naar genomen die alle α, ten minste één β-variant en geen andere belangrijke varianten bevatten.
“Met onze tools hebben we de verspreiding en vervanging van heersende stammen in Europa (αβε met αβζ) en Azië (α met αβε) waargenomen, het overwicht van dezelfde stam voor het grootste deel van de pandemie in Noord-Amerika (αβ-δ), en de voortdurende aanwezigheid van meerdere hoogfrequente soorten in Azië en Noord-Amerika, ”zei Pond.
Om de oorzaak van het probleem te achterhalen
Om het voorlopercellengenoom te identificeren, gebruikten ze een benadering die niet eerder op SARS-CoV-2 was toegepast, genaamd mutatie-orderanalyse. De techniek, die veel wordt gebruikt bij kankeronderzoek, is gebaseerd op een klonale analyse van mutante stammen en de frequentie waarmee paren mutaties samen verschijnen om de wortel van het virus te vinden.
Veel eerdere pogingen om zulke grote datasets te analyseren waren niet succesvol vanwege “de focus op het bouwen van een evolutionaire boom van SARS-CoV-2”, zegt Kumar. “Dit coronavirus evolueert te traag, het aantal te analyseren genomen is te groot en de datakwaliteit van genomen is zeer variabel. Ik zag meteen parallellen tussen de eigenschappen van deze genetische gegevens van het coronavirus en de genetische gegevens van de klonale verspreiding van een andere snode ziekte, kanker. “
Kumar en Miura hebben veel technieken ontwikkeld en onderzocht om genetische gegevens van tumoren bij kankerpatiënten te analyseren. Ze hebben deze technieken aangepast en geïnnoveerd om een spoor van mutaties op te bouwen dat teruggaat tot de genetische vingerafdruk van de voorlopercellen. “De benadering van het volgen van mutaties leverde de voorloper en de familiegeschiedenis van zijn belangrijkste mutatie op. Het is een goed voorbeeld van hoe big data in combinatie met biologisch geïnformeerde datamining belangrijke patronen blootlegt ”, aldus Kumar.
Een eerdere tijdlijn komt naar voren “Dit voorlopergenoom had een sequentie die heel anders was dan wat sommige mensen de referentiesequentie noemen, wat als eerste werd waargenomen in China en werd gedeponeerd in de GISAID SARS-CoV-2-database”, zei Kumar.
De beste overeenkomst was die van acht genomen die 26 tot 80 dagen na het vroegst bemonsterde virus van 24 december 2019 waren bemonsterd. Meerdere nauwe overeenkomsten werden gevonden in alle bemonsterde continenten en pas in juni 2020 (pandemiedag 181) in Zuid-Amerika gedetecteerd. In totaal bevatten 140 genomen die Kumar’s groep analyseerde, allemaal alleen synonieme verschillen met proCoV2. Dat wil zeggen, al hun eiwitten waren identiek aan de overeenkomstige proCoV2-eiwitten in de aminozuursequentie. Een meerderheid (93 genomen) van deze overeenkomsten op eiwitniveau was afkomstig van coronavirussen die werden bemonsterd in China en andere Aziatische landen.
Deze spatiotemporele patronen suggereerden dat proCoV2 al het volledige repertoire van eiwitsequenties bezat dat nodig is om de wereldwijde menselijke populatie te infecteren, te verspreiden en te behouden.
Ze vonden het proCoV2-virus en de eerste nakomelingen ervan ontstonden in China, op basis van de vroegste mutaties van proCoV2 en hun locaties. Bovendien toonden ze ook aan dat er ten tijde van de eerste detectie van COVID-19-gevallen in China een populatie van stammen bestond met ten minste drie mutatieverschillen met proCoV2. Met schattingen dat SARS-CoV-2 25 mutaties per jaar zou krijgen, betekende dit dat het virus al enkele weken voor de gevallen van december 2019 mensen had geïnfecteerd.
Mutationele handtekeningen
Omdat er sterk bewijs was van veel mutaties vóór degene die in het referentiegenoom werden gevonden, moest Kumar’s groep een nieuwe nomenclatuur van mutatiesignaturen bedenken om SARS-CoV-2 te classificeren en deze te verklaren door een reeks Griekse lettersymbolen te introduceren bij vertegenwoordigen elk.
Ze ontdekten bijvoorbeeld dat de opkomst van α SARS-CoV-2-genoomvarianten vóór de eerste meldingen van COVID-19 kwam. Dit impliceert sterk het bestaan van enige sequentiediversiteit in de voorouderlijke SARS-CoV-2-populaties. Alle 17 genomen die in december 2019 uit China zijn bemonsterd, inclusief het aangewezen SARS-CoV-2-referentiegenoom, dragen alle drie α-varianten. Maar er werden tot juli 2020 1.756 genomen zonder α-varianten over de hele wereld bemonsterd. Daarom waren de vroegst bemonsterde genomen (inclusief de aangewezen referentie) niet de voorloperstammen.
Het voorspelt ook dat het voorlopercellengenoom nakomelingen had die zich wereldwijd verspreidden tijdens de vroegste fasen van COVID-19. Het was vanaf het begin klaar om te infecteren.
“De stamvader had al het vermogen om zich te verspreiden”, zei Pond. “Er is een overvloed aan niet-synonieme veranderingen in de bevolking. Wat er tussen vleermuizen en mensen is gebeurd, blijft onduidelijk, maar proCoV2 kan al op pandemische schaal infecteren. “
Een wereldwijde spreiding
In totaal hebben ze zeven belangrijke evolutionaire lijnen geïdentificeerd en de episodische aard van hun wereldwijde verspreiding. Het proCoV2-genoom heeft geleid tot vele belangrijke afstammingslijnen, waarvan sommige ontstonden in Europa en Noord-Amerika na de waarschijnlijke genese van de voorouderlijke lijnen in China.
“Aziatische soorten hebben de hele pandemie veroorzaakt”, zei Kumar. “Maar in de loop van de tijd infecteren veel varianten die elders zijn ontstaan, Azië nu veel meer.”
Hun op mutaties gebaseerde analyses stelden ook vast dat Noord-Amerikaanse coronavirussen heel andere genoomsignaturen hebben dan die in Europa en Azië.
“Dit is een dynamisch proces”, zei Kumar. “Het is duidelijk dat er heel verschillende afbeeldingen van verspreiding zijn die worden geschilderd door de opkomst van nieuwe mutaties, de drie εs, γ & delta, die we ontdekten na de verandering van het piekeiwit (een β-mutatie). Wetenschappers zijn nog aan het uitzoeken of functionele eigenschappen van deze mutaties de pandemie hebben versneld. “
Opmerkelijk is dat de mutatiesignatuur van αβ-δ sinds april 2020 de dominante lijn in Noord-Amerika is gebleven, in tegenstelling tot de omslag in Europa en Azië. Meer recentelijk zijn nieuwe snelverspreidende varianten, waaronder een S-eiwitvariant (N501Y) uit Zuid-Afrika en het VK (B.1.1.17), snel toegenomen. Coronavirussen met N501Y-variant in Zuid-Afrika dragen de αβγδ genetische vingerafdruk, terwijl die in het VK de αβε genetische vingerafdruk dragen, volgens hun classificatieschema. “Daarom blijft de αβ-voorouder aanleiding geven tot veel grote uitlopers van dit coronavirus.” Zei Kumar.
Realtime updates
De MBE-studie was gebaseerd op drie snapshots en werd opgehaald uit GISAID op 7 juli 2020 (een dataset van 60.332 genomen), 12 oktober 2020 (bevatte 133.741 genomen), en tot slot, een uitgebreide dataset van 172.480 genomen bemonsterd op 30 december, 2020.
In de toekomst zullen ze hun resultaten blijven verfijnen naarmate er nieuwe gegevens beschikbaar komen.
“Meer dan een miljoen SARS-CoV-2-genomen worden nu gesequenced”, zei Pond. “De kracht van deze benadering is dat hoe meer gegevens je hebt, hoe gemakkelijker je de precieze frequentie van individuele mutaties en mutatieparen kunt bepalen. Deze varianten die worden geproduceerd, de enkele nucleotidevarianten of SNV’s, hun frequentie en geschiedenis kunnen heel goed worden verteld met meer gegevens. Daarom leiden onze analyses een geloofwaardige wortel af voor de SARS-CoV-2-fylogenie. “
De MBE-studie maakt deel uit van hun inspanningen om een continue, live real-time monitoring van SARS-CoV-2-genomen te behouden, die nu is uitgegroeid tot meer dan 350.000 genomen.
“We hebben een live dashboard opgezet met regelmatig bijgewerkte resultaten, omdat de processen van data-analyse, manuscriptvoorbereiding en collegiale toetsing van wetenschappelijke artikelen veel langzamer zijn dan het tempo van de uitbreiding van SARS-CoV-2-genoomverzameling”, aldus Pond. “We bieden ook een eenvoudige“ in-the-browser ”tool om elk SARS-CoV-2-genoom te classificeren op basis van sleutelmutaties die zijn afgeleid door de MOA-analyse.
“Deze bevindingen en onze intuïtieve mutatie-vingerafdrukken en streepjescodes van SARS-CoV-2-stammen hebben ontmoedigende uitdagingen overwonnen om een retrospectief te ontwikkelen over hoe, wanneer en waarom COVID-19 is ontstaan en zich heeft verspreid, wat een voorwaarde is om remedies te creëren om deze pandemie te overwinnen. door de inspanningen van wetenschap, technologie, openbaar beleid en geneeskunde, ”zei Kumar.
Referentie: 4 mei 2021, Moleculaire biologie en evolutie.
DOI: 10.1093 / molbev / msab118